一氧化碳CO的分子结构介绍
- 发布时间:2023-04-11
- 发布者: 本站
- 来源: 原创
- 阅读量:
CO分子是由一个C原子和一个O原子结合成的异核双原子分子,分子形状为直线形。根据电子配对法(价键理论),C原子(1s22s22px2py)和O原子(1s22s22px22py2pz)各含两个未成对的电子,由此可以构成两个共价键:一个是2px沿x轴偶合构成的σ键,另一个是2py电子沿x轴“肩并肩”构成π键。与此相应的,其双键的特性应该与一般的碳氧双键(羰基)一样,即键长为121 pm、键能为724 kJ/mol〔约173千卡/克键,克键指1克分子(gram-atom)物质所含键的数量,即1mol键 〕、偶极矩为7.7×10-30C·m(约2.3德拜)。但实际测得CO的键长为113 pm,比一般碳氧双键的短;键能为1071.1kJ/mol(约256千卡/克键),比一般碳氧双键的大;偶极矩为3.3×10-31 C·m(约0.1德拜),约为一般碳氧双键的 。由于以上矛盾,有学者提出了三重键的结构式: ,即在CO分子中,除有一个σ键和一个π键外,还有一个配位键(用“←”表示)。
而按照分子轨道法(分子轨道理论),可以自然地得到CO分子具有三重键的结构。按照分子轨道法,CO分子轨道是由C原子轨道和O原子轨道组合而成的,CO分子轨道形成式为
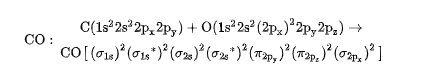
从CO分子轨道形成式来看,CO分子和N2分子结构十分相似,都是以三重键(σ+π+π)结合的:一个σ键(),两个π键(和),其中一个π键为配位键,共用电子对由O原子提供。其成键过程为:C原子的最外层有4个电子,O原子的最外层有6个电子,C原子的2个单电子进入到O原子的p轨道和O原子的2个单电子配对成键,形成两个共价键,然后O原子的孤电子对进入到C原子空的P轨道中形成一个配位键,总共形成了三个共价键。
由于是CO分子是以三重键结合的,故CO的键长比一般碳氧双键短、键能比一般碳氧双键大;同时,由于O原子的电负性比C原子的高,电子云应该偏向O原子,从而CO分子应该有较大的偶极矩,但CO分子中形成配位键的电子对是由O原子单独提供的,使电子云又反馈到C原子上,在一定程度上补偿了因O原子和C原子间电负性差所造成的极性,使得CO分子偶极矩很小,与CO分子偶极矩很小的事实一致。













